Symposium zu Post-Marketing-Studien (Anwendungsbeobachtungen) in Deutschland und Europa – tragen sie zur Arzneimittelsicherheit bei?
Datum:
16.11. 11:00 Uhr - 16.11.2017 17:00 Uhr
Ort: Berlin
Arzneimittel sollten wirksam und sicher sein. Deshalb müssen Medikamente sich auch nach ihrer Zulassung in sogenannten Post-Marketing-Studien beweisen, so verlangt es das Europäische Arzneimittelrecht. Die Arzneimittelgesetze der EU Mitgliedsländer sprechen auch von Phase IV Studien, von Post-Marketing-Surveillance oder von Anwendungsbeobachtungen (AWB). Post-Marketing-Studien sollen der Arzneimittelsicherheit (Pharmakovigilanz) dienen und müssen in Deutschland den Aufsichtsbehörden gemeldet werden. Unser Symposium beleuchtet aufbauend auf eigenen Forschungsarbeiten in Deutschland und Österreich die Praxis von Post-Marketing-Studien und ihr Potential für Missbrauch und korruptive Einflussnahme.
Veranstaltungsbericht
Hier finden Sie alle Beiträge und eine kurze Zusammenfassung des jeweiligen Vortrags.
Prof. Dr. Dr. h.c. mult. Hartmut Graßl, Vorstandsvorsitzender der Vereinigung Deutscher Wissenschaftler (VDW e.V.)
Grußwort
Liebe Kollegen, meine Damen und Herren,
es freut mich sehr, dass die VDW-Studiengruppe „Gesundheit“ diese internationale Tagung ausrichtet und zwar zu „Post-Marketing-Studien (Anwendungsbeobachtungen) in Deutschland und Europa –tragen sie zur Arzneimittelsicherheit bei?“. Dieses Thema fällt wie einige andere in den Bereich „gibt es eine ausreichende Kontrolle durch den Souverän, also das Parlament?“. Das Fragezeichen ist in einigen Bereichen als mit einem Nein beantwortet worden. Ich nenne nur drei Bereiche mit kaum funktionierender Kontrolle, wodurch auch das Vorsorgeprinzip, eine Leitlinie der Europäischen Union, ausgehebelt wird. In allen drei Fällen geht es vorwiegend oder auch um die Gesundheit von Menschen:
- Schadstoffemission der Automobile, speziell in Deutschland
- Gefährdung der Gesundheit und Verlust an biologischer Vielfalt durch Pestizide (hierzu wurde der Whistleblower-Preis 2015 an Gilles-Éric Séralini verliehen)
- Kontrolle der Krebsmedikamente aus Apotheken (hierzu wird am 1. Dezember 2017 in Kassel der Whistleblower-Preis an zwei Mitarbeiter der „Alten Apotheke“ in Bottrop verliehen)
Ich hoffe, dass wir heute im Vergleich der beiden Länder Österreich und Deutschland voneinander lernen können, und auch Wege aufzeigen, wie unsere Gesundheit gestärkt wird, wenn die Parlamente ihre Kontrollfunktion ausüben können. Ich hoffe außerdem, dass die Präsentationen auch den Weg über die Webseiten der Veranstalter hinausfinden, d.h., dass es zu einer Publikation kommt.
Prof. Dr. Dr. Jürgen Marten, Vorstandsmitglied von Transparency International Deutschland e.V.
Grußwort
Gesundheit, meine Damen und Herren, ist ein bedeutendes gesellschaftliches und individuelles Gut. Daran besteht mit Sicherheit bei niemandem Zweifel, denn alle sind betroffen und erfahren das. Gesundheit und die Maßnahmen und Mittel ihrer Sicherung und ihres Schutzes bedürfen deshalb auch besonderer gesellschaftlicher Aufmerksamkeit, Verantwortung und Kontrolle. Aber: Gesundheit ist auch ein „Wirtschaftsgut“ und der „Gesundheitsmarkt“ ist ein Feld zugespitzter wirtschaftlicher und sozialer Auseinandersetzungen. Dass die Ziele gesellschaftlicher Entwicklung und die der Wirtschaft in Widerspruch geraten, dass Wirtschaft sich die Gesellschaft subsumiert und ökonomische Imperative, d. h. Profitinteressen zum beherrschenden Maßstab werden, beobachten wir allenthalben, auch in Bezug auf den Gesundheitsmarkt und insbesondere betreffend den Arzneimittelmarkt.
Arzneimittel, so regelt es das europäische Arzneimittelrecht und das deutsche Arzneimittelgesetz, müssen wirksam und sicher sein. Die allgemeine Beschwichtigungsformulierung der werbenden Pharmaindustrie „Zu Risiken und Nebenwirkungen lesen Sie die Packungsbeilage und fragen Sie Ihren Arzt oder Apotheker“ bietet keine ausreichende Grundlage, Patienten Sicherheit zu vermitteln. Es bedarf bei der Einführung und Anwendung von Medikamenten wissenschaftlicher Studien. Eine besondere Rolle spielen dabei die sog. Phase 4 – Studien, d. h. die Post-Marketing-Studien, die der Gewinnung von Erkenntnissen bei der Anwendung verkehrsfähiger Arzneimittel, d.h. bereits zugelassener Arzneimittel dienen und Gegenstand des heutigen Symposiums sind.
Die Pharmaindustrie hat unter dem wissenschaftlich nur wenig belastbaren Begriff „Anwendungsbeobachtungen“ Ärzte bei Zahlungen von nicht unerheblichen Honoraren dazu veranlasst, die Wirkungen und Nebenwirkungen bestimmter Medikamente aufzudecken und zu melden, auch – wie das rechtlich vorgeschrieben ist - den Behörden, also dem Bundesamt für Arzneimittelsicherheit, sowie dem GKV-Spitzenverband und der KBV. Diese Informationen sind jedoch öffentlich nicht zugänglich gemacht worden. Das verhärtete den Verdacht, Anwendungsbeobachtungen seien reine Marketinginstrumente der Pharmaindustrie, legalisierte Korruption und keineswegs nicht zu beanstandende Forschungsergebnisse. Transparency International Deutschland hat sich gegen erhebliche Widerstände seit 2011 mit diesem Problem beschäftigt. Sich auf das Informationsfreiheitsgesetz berufend hat es von den entsprechenden Behörden und Körperschaften gefordert, die diesen übermittelten Meldungen öffentlich zu machen. BfArM und KBV mussten erst mit gerichtlicher Hilfe dazu gezwungen werden. Aber auch innerhalb von TI Deutschland mussten Widersprüche überwunden und ein handlungsorientiertes Verständnis für die Problematik entwickelt werden.
Die Aktivisten von TI haben dies freiwillig, pro bono und mit großem Einsatz getan. Sie haben selbst in diesem Prozess neue Einsichten gewonnen. Stand am Anfang noch die Forderung eines Verbots der sogenannten Anwendungsbeobachtungen, ist dies einer differenzierteren Sicht gewichen. Es gibt gute Gründe dafür, Post-Marketing-Studien als gesundheitspolitisch wünschenswerte Instrumente zu akzeptieren. Das setzt jedoch voraus, dass sie erstens Kriterien berücksichtigen und Methoden anwenden, die sie als tatsächlich wissenschaftliche Studien, d. h. nicht zu beanstandende Forschungsvorhaben gemäß der Helsinki-Deklaration qualifizieren. Zweitens gehört dazu aber insbesondere auch, dass die Methoden und Ergebnisse der Forschungen öffentlich verfügbar gemacht werden. Daten aus Arzneimittelstudien dürfen keine Betriebs- und Geschäftsgeheimnisse sein. Offensichtlich entspricht die Mehrzahl der gegenwärtig realisierten Postmarketingstudien nicht den erforderlichen wissenschaftlichen Kriterien. Der begründete Verdacht, es handele sich um eine gezielte, auch materiell fundierte, Beeinflussung von Ärzten, gar um Bestechlichkeit i. S. von § 299 a StGB, steht nach wie vor im Raum.
Die heutige Diskussion der bisherigen Rechercheergebnisse mit einem qualifizierten Fachpublikum soll ein weiterer Schritt dazu sein, dass die in Post-Marketing-Studien erhobenen Daten zukünftig als nicht zu beanstandende Forschung für die Arzneimittelsicherheit der Öffentlichkeit und für eine unabhängige wissenschaftliche Überprüfung zugänglich gemacht werden. Ich wünsche dem Symposium Erfolg, von dem ich überzeugt bin, und eine große gesellschaftliche Wirksamkeit.
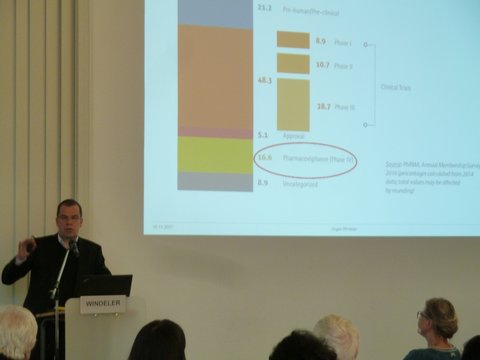
Prof. Dr. med. Jürgen Windeler - Leiter des Instituts für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWiG)
Erkenntnisse nach der Zulassung eines Medikaments – was brauchen wir und was bekommen wir?
Die Zulassung von Arzneimitteln erfolgt auf der Basis von klinischen Studien, deren Ergebnisse eine erste Bewertung insbesondere der Unbedenklichkeit eines Medikaments erlauben. Gleichzeitig bleiben nach diesen Studien noch viele für die Anwendung von Arzneimitteln relevante Fragen offen. Neben erweiterten Nutzen- bzw. Schadenaspekten geht es dabei auch um den Vergleich verschiedener Arzneimittel in sogenannten Head-to-Head-Studien. Die Situation verschärft sich zusehends durch die immer frühere Zulassung von Arzneimitteln, insbesondere in der Onkologie. Nach der Zulassung verliert der pharmazeutische Unternehmer das Interesse, solche Fragen zu beantworten. Stattdessen werden Anwendungsbeobachtungen finanziert, die im Wesentlichen als Marketingmaßnahme bezeichnet werden können. Sie adressieren daher die Fragen, die sie beantworten könnten, nicht, und sind gleichzeitig nicht in der Lage, zu den wichtigen Fragen der Versorgung Beiträge zu leisten. Falls man für die pharmazeutische Industrie eine Verantwortung sieht, sich an der Beantwortung solcher Fragen zu beteiligen, so stellt sich die Frage, mit welchen Maßnahmen bzw. Anreizen dies durchgesetzt werden kann. Falls man diese Verantwortung nicht bejaht, wäre zu diskutieren, mit welchen Mitteln diese Aufgabe realisiert werden kann.
PD Dr. Claudia Wild - Leiterin des Ludwig Boltzmann Institut Health Technology Assessment
Ergebnisse systematischer Analysen nicht – interventioneller Studien in Österreich
Hintergrund: In Österreich sind NIS nicht genehmigungs-, aber meldepflichtig. Es ist gesetzlich ein Register der NIS zu führen und zusätzlich eine öffentliche Datenbank mit festgelegten Informationsinhalten online anzubieten. Im Rahmen einer systematischen Analyse des LBI-HTA (2015, update 2017) wurde primär der Frage nachgegangen, was das Erkenntnisinteresse der registrierten NIS ist.
Methode: Zum Stichtag 3. April 2017 (Update zu Forschungsfragen der NIS) bzw. 7. Aug. 2015 (Frage nach Anzahl, Umfang und Indikationsbereich der NIS) wurden die in der öffentlichen Datenbank verfügbaren Informationen zu den erfassten NIS systematisch ausgewertet. Darüber hinaus wurden die Verantwortlichen all dieser NIS per E-Mail mit dem Ersuchen um zusätzliche Informationen kontaktiert.
Ergebnis: Am Stichtag 7. Aug. 2015 waren in der öffentlichen Datenbank 251 NIS verzeichnet, die 581 Arzneimittel an geplanten 406.831 PatientInnen untersuchten. 191 NIS wurden von Pharmafirmen selbst durchgeführt. 15 Firmen führen ≥ 4 NIS durch und sind für 105 NIS mit 59.438 PatientInnen verantwortlich. Die häufigsten untersuchten Arzneimittelgruppen waren antineoplastische und immunmodulierende Substanzen, hochpreisige Medikamente. Am Stichtag 3. April 2017 waren 72 Kurzfassungen der Abschlussberichte abrufbar und bereits 325 NIS verzeichnet. Lediglich 16 der 72 Kurzfassungen waren vollständig, sie erfüllten die in der betreffenden Verordnung geregelten formalen Erfordernisse tatsächlich. Die Forschungsfragen sind überwiegend nach Effektivität, Sicherheit und Verträglichkeit unter Bedingungen des klinischen Alltags. Die Studienergebnisse sind in der Regel positiv im Sinn der jeweiligen Forschungsfrage, nur 2 Kurzfassungen enthalten auch negative Ergebnisse. Die untersuchten Arzneimittel sind vornehmlich patentierte Analogpräparate und/oder Generika/Biosimilars.
Schlussfolgerung: Es zeigt, dass mit der Zeit mehr und mehr Kurzfassungen der Abschlussberichte in die Datenbank eingestellt werden. Einige dieser NIS sind auch in internationalen Trialregistern aufgeführt und publizieren ihre Ergebnisse auch wissenschaftlich. Die Qualität der Datenbank (Wartung und Kontrolle der Inhalte) ist fast zwei Jahre nach dem ersten Untersuchungszeitpunkt unverändert schlecht. Das Fazit ist, dass aufgrund des Mangels an formalen Meldeanforderungen für die öffentliche Datenbank (etwa Dokumentation des Erkenntnisinteresses bereits zu Beginn einer NIS) und bescheidener Meldemoral und Meldekontrolle (zeitnaher Abschlussbericht und Meldung der geforderten Informationen) es gegenwärtig in Österreich einer informierten Öffentlichkeit nicht möglich ist, fundierte Aussagen zu den durchgeführten NIS zu machen.
Dr.med. Angela Spelsberg, S.M. - Ärztliche Leiterin Tumorzentrum Aachen e.V. und Leiterin der Arbeitsgruppe Gesundheitswesen von Transparency International Deutschland e.V.
Prof. Dr. med. Ulrich Keil, PhD - Institut für Epidemiologie und Sozialmedizin der Universität Münster
Ergebnisse einer Untersuchung von Meldungen industriefinanzierter Post-Marketing Studien an Regulierungsbehörden in Deutschland
Die Antikorruptionsorganisation Transparency International geht seit 2011 unter Anwendung des Informationsfreiheitsgesetzes (IFG) systematisch der Frage nach: Sind Post-Marketing Studien, in Deutschland „Anwendungsbeobachtungen“ genannt, nicht zu beanstandende Forschungsvorhaben gemäß der Declaration of Helsinki (DoH), oder den Prinzipien der Good Pharmacovigilance Practice (GPVP), oder stellen sie eine gezielte Beeinflussung von Ärzten dar? Wäre eine Teilnahme für Ärzte nach §299a StGB (Gesetz zur Bekämpfung der Korruption im Gesundheitswesen) demnach strafbar? Nach den uns jetzt vorliegenden Erkenntnissen aus der Analyse von 6925 Seiten Originalunterlagen zu 558 PMS wird bei Post-Marketing-Studien, in Deutschland „Anwendungsbeobachtungen“ genannt, regelhaft sowohl gegen die Deklaration von Helsinki als auch gegen das ärztliche Berufsrecht verstoßen. Post-Marketing Studien müssen somit als potentiell zu beanstandende Forschungsprojekte ohne wissenschaftlichen Aussagegehalt und als Instrumente zur gezielten Beeinflussung des ärztlichen Verordnungsverhaltens eingestuft werden. Sie dienen nicht der Arzneimittelsicherheit.
LL.M. (Duke Univ.), Dr. jur. Christoph Partsch, Partsch & Partner Rechtsanwälte
Zugang zu Meldungen industriefinanzierter Post-Marketing Studien – Die Bedeutung des Informationsfreiheitsgesetzes in Deutschland
§ 67 Abs. 6 AMG verpflichtet KBV und BfArM seit 2009 zur Offenlegung von Post-Marketing Studien. Dieser gesetzlichen Pflicht sind diese lange Jahre nicht nachgekommen. Die von den ineffizienten und zum Teil korrupten Behörden Deutschlands, insbesondere dem Bundesministerium des Inneren, stets bekämpften Informationszugangsrechte auf Bundes- und oder Landesebene können ein wirksames Mittel für NGOs sein, um die von den Aufsichtsbehörden unterlassene Transparenz einzufordern. Im Fall hat Transparency Deutschland durch zwei taktisch geführte verwaltungsgerichtliche Verfahren vor dem VG Berlin und dem VG Köln das Bundesinformationsfreiheitsgesetz IFG eingesetzt, um von der KBV und dem BfArM die nach § 67 Abs. 6 AMG veröffentlichungspflichtigen Informationen. einzuklagen. PresseG, Art. 5 GG, BArchG und Informationsfreiheitsgesetze (Bundes IFG, Landes IFG, Bundes UIG, Landes UIG, VIG usw.) sind verbesserungswürdige, aber effiziente Mittel, um NGOs die nötigen Informationen für ihre Tätigkeit zu geben. Durch verwaltungsgerichtliche Verfahren kann darüber hinaus hohe Publizität mit geringem finanziellen Einsatz erzielt werden.
Prof. Dr. med Sebastian Harder - Institut für Klinische Pharmakologie, Goethe Universität Frankfurt / Vorsitzender der Ethikkommission des Fachbereichs Medizin der Goethe Universität Frankfurt
Anwendungsbeobachtungen und Ethikkommission. Werden Ethikkommissionen umfassend informiert; sind sie sich der Tragweite ihrer Entscheidungen bewusst?
Die Deklaration von Helsinki (DoH) legt ethische Grundsätze für medizinische Forschung am Menschen, einschließlich der Forschung an identifizierbaren menschlichen Daten fest. Forschung an Daten umfasst auch die arzneimittelepidemiologische Forschung im Bereich der sog. Postmarketing-Studien. Für Forschungsvorhaben gilt gemäß der DoH generell (1) dass sie allgemein anerkannten wissenschaftlichen Grundsätzen entsprechen sollen, (2) Planung und Durchführung des Vorhabens klar in einem Studienprotokoll beschrieben werden muss, und (3) dieses Studienprotokoll vor Studienbeginn zur Beratung und Zustimmung einer zuständigen Forschungs-Ethikkommission vorzulegen ist. Für die sog. nichtinterventionellen Studien (NIS oder Beobachtungsstudien), als deren eine Untergruppe das deutsche Arzneimittelgesetz gemäß § 67 (6) die Anwendungsbeobachtungen heraushebt, ist somit wegen des Bezugs auf identifizierbare Patientendaten ein Ethikvotum nötig. Ärztinnen und Ärzte, die sich an solchen Vorhaben beteiligen, müssen sich gemäß der Berufsordnung unter Bezug auf die DoH durch eine Ethikkommission (angesiedelt bei Universitäten oder Ärztekammern) beraten lassen. Diese Vorgabe wird nach gegenwärtiger Praxis in Deutschland auch durch pharmazeutische Firmen weitgehend beachtet. Dadurch kommt den jeweiligen Ethikkommissionen die nicht immer willkommene Aufgabe zu, eine AWB beraten und votieren zu müssen. Andererseits gibt es mit dem Antrag auf Beratung eines Forschungsvorhabens generell keinen Anspruch auf ein positives Votum, wobei die Verweigerung eines positiven Votums bei interventionellen Studien auch immer das individuelle Risiko des Patienten durch die Studienteilnahme ins Kalkül zieht.
Bei nichtinterventionellen Studien wie einer AWB ist ein individuelles Risiko eines studienbedingten Schadens bis auf eine Verletzung des Datenschutzes nicht vorhanden, was den Sanktionierungsrahmen der Ethikkommission einschränkt. Eine Ablehnung von AWB kann sich aber auch auf Nichterfüllen methodischer Kriterien des Vorhabens begründen, und auf der Abwägung des sog. Gruppennutzes (z.B. durch das Erkennen von bisher nicht bekannten Arzneimittelrisiken) gegen einen Gruppenschaden (z.B. durch Promotion eines unnötig teuren Präparates zu Lasten der Beitragszahler, durch eine selektive Datenerhebung oder intentional irreführende Datenanalyse, die Fehlinformationen generiert). Das Gebot der Forschungsfreiheit muss aber hierbei sorgfältig gegenüber Mutmaßungen missbräuchlicher Absichten des Forschers bzw. seines Auftraggebers abgewogen werden, um nicht jedes Kind mit dem Bade auszuschütten.
PD Dr. med. Christof Prugger - MSc Institut für Public Health, Charité Universitätsmedizin
Wie kann die Situation von Post-Marketing Studien in Deutschland weiter untersucht werden?
In Deutschland sind Anzeigen zu Post-Marketing Studien (PMS) seit August 2013 öffentlich zugänglich. Eine unabhängige Untersuchung inhaltlicher und methodischer Aspekte dieser PMS Daten ist überfällig. Von besonderem Interesse ist die Frage, ob sich die Praxis von PMS nach den Änderungen des Arzneimittelgesetzes (AMG) 2012 und 2013 verändert hat. Als weiterführende Untersuchung unserer Arbeit zu Anzeigen von PMS (Spelsberg et al. BMJ 2017) führen wir deshalb aktuell eine Trendanalyse für den Vergleich der Zeiträume 2008-2010 und 2014-2016 durch. Anhand dieses zeitlichen Vergleichs soll die Frage beantwortet werden, welchen Effekt die AMG-Änderungsgesetze von 2012 und 2013 auf die Praxis von PMS hatten. Im Rahmen dieser Untersuchung planen wir auch, methodische Aspekte von in Deutschland durchgeführten PASS (Post-Authorisation Safety Studies) zu untersuchen.
In Europa werden neue Medikamente von der Europäischen Zulassungsbehörde (EMA) immer häufiger ohne abschließende Evidenz zu deren Wirksamkeit und Sicherheit zugelassen. Die Inhaber dieser bedingten Zulassungen werden dann von der EMA mit der Auflage belegt, die Wirksamkeit der Medikamente in PASS nachzuweisen. Entsprechend verschiebt sich die Beweislast von Phase III randomisierten klinischen Studien auf PASS. Eine transparente, kritische Bewertung der von der Wissenschaft bisher vernachlässigten PASS ist deshalb dringend notwendig. In einem Pilotprojekt sollen translationale Rahmenbedingungen geschaffen werden für regulatorische Forschung, um die Transparenz von PASS zu erhöhen, eine kritische Bewertung von PASS zu ermöglichen und die Evaluation der Medikamentensicherheit zu stärken.
Abschlussdiskussion aller Referenten unter Einbeziehung des Plenums:
Was muss geschehen, damit Post-Marketing Studien zur Arzneimittelsicherheit beitragen können?
Zur Abschlussdiskussion
Deutscher Bundestag: Arzneimittelstudien genau dokumentiert (Meldung vom 13.04.2016)